این آژانس روز دوشنبه اعلام کرد که یک جفت دستگاه قلبی مرتبط با صدها جراحت و حداقل 14 مورد مرگ، جدی ترین فراخوان FDA را دریافت کرده است.
این فراخوان سالها پس از آن صورت میگیرد که جراحان گفتند برای اولین بار متوجه مشکلاتی در HeartMate II و HeartMate 3 تولید شده توسط Thoratec Corp، یکی از شرکتهای تابعه Abbott Laboratories شدهاند. دستگاه ها در حال حاضر از بازار حذف نمی شوند. در یک پاسخ ایمیلی، ابوت گفت که این ریسک را امسال به مشتریان اعلام کرده است.
این اقدام به تعویق افتاده سوالاتی را برای برخی از حامیان ایمنی در مورد چگونگی و زمان گزارش مشکلات مربوط به دستگاه های پزشکی تایید شده ایجاد می کند. دستگاه های قلب مورد بحث با هزاران گزارش از جراحات و مرگ بیماران همراه بوده است، همانطور که در تحقیقات KFF Health News در اواخر سال گذشته توضیح داده شد.
“چرا مردم نمی دانند؟” Sanket Dhruva، متخصص قلب و متخصص در ایمنی تجهیزات پزشکی و مقررات در دانشگاه کالیفرنیا-سان فرانسیسکو گفت. اگرچه برخی از جراحان ممکن است از مسائل آگاه بوده باشند، برخی دیگر، به ویژه آنهایی که دستگاه را مرتباً کاشت نمی کنند، ممکن است در تاریکی بوده باشند. او گفت: «و بیماران آنها از عوارض جانبی رنج می برند.
این فراخوان شامل یک جفت پمپ مکانیکی است که به قلب کمک می کند خون را در زمانی که به تنهایی قادر به انجام این کار نیست پمپاژ کند. این دستگاهها به اندازهای کوچک هستند که در کف دست قرار میگیرند، در بیماران مبتلا به نارسایی قلبی در مرحله نهایی که منتظر پیوند هستند یا به عنوان یک راهحل دائمی زمانی که پیوند گزینهای نیست، کاشته میشوند. این فراخوان تقریباً 14000 دستگاه را تحت تأثیر قرار می دهد.
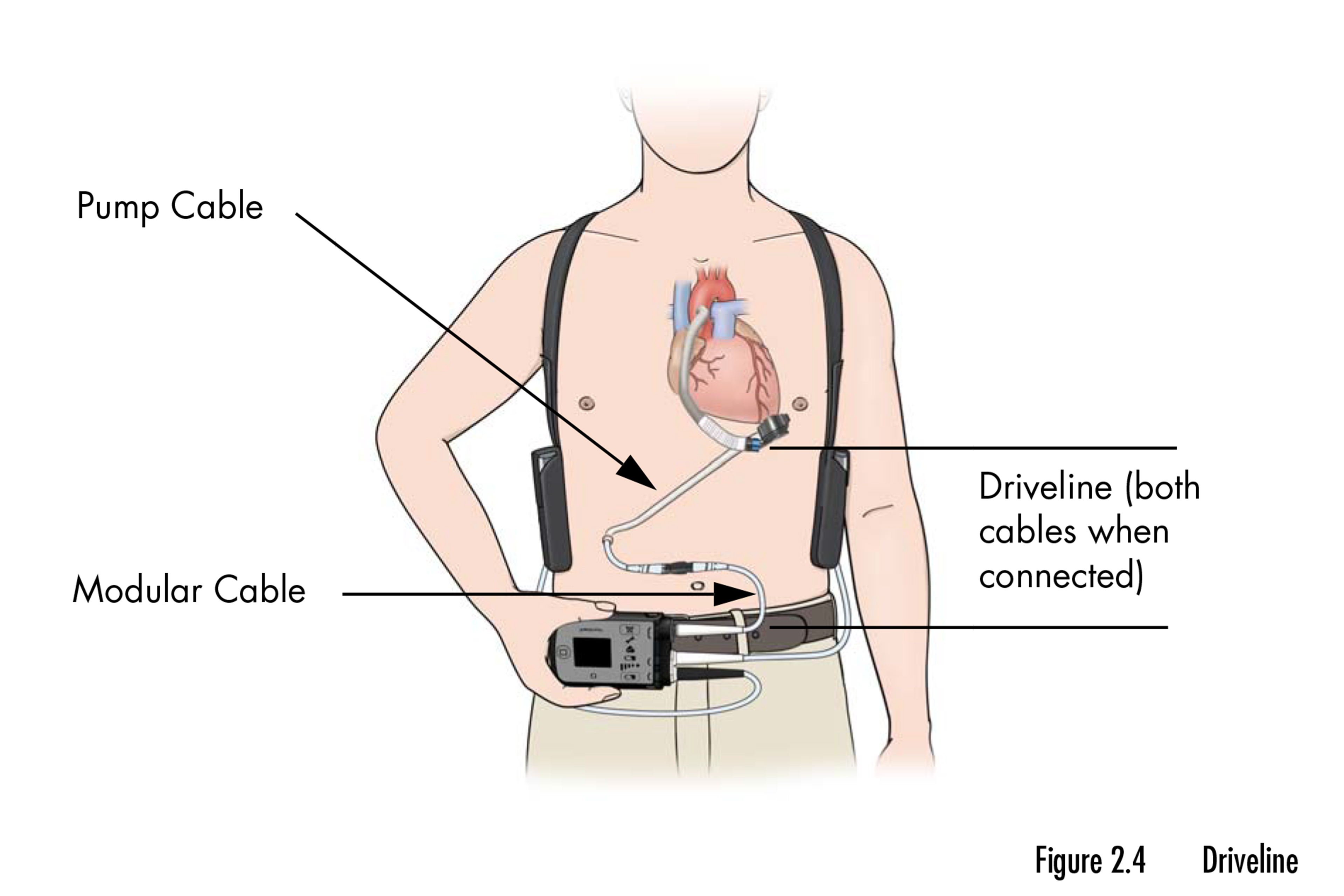
آماندا هیلز، یک مسئول مطبوعاتی FDA، گفت که آژانس با ابوت برای بررسی جراحات و مرگهای گزارششده و تعیین اینکه آیا اقدامات بیشتری لازم است یا خیر کار میکند.
هیلز در ایمیلی گفت: «تا به امروز، تعداد مرگهای گزارششده با عوارض جانبی مشاهدهشده در کارآزمایی بالینی اولیه مطابقت دارد».
بر اساس اعلامیه فراخوان FDA، این دستگاه ها می توانند باعث ایجاد “مواد بیولوژیکی” شوند که توانایی آنها را برای کمک به گردش خون به قلب و زنده نگه داشتن بیماران کاهش می دهد. تجمع به تدریج جمع می شود و می تواند دو سال یا بیشتر پس از کاشت دستگاه در قفسه سینه بیمار ظاهر شود.
به پزشکان توصیه شد که مراقب «آژیرهای جریان کم» روی دستگاهها باشند و در صورت تشخیص انسداد، بیمار را زیر نظر بگیرند یا برای کاشت استنت، رفع انسداد یا تعویض پمپ، جراحی انجام دهند. جاستین پاکت، سخنگوی ابوت در ایمیلی گفت: «نرخ انسداد خروجی پایین است» و افزود بیمارانی که دستگاههایشان به طور معمول کار میکنند «دلیلی برای نگرانی ندارند».
بررسی پایگاه داده دستگاه FDA حداقل 130 گزارش مربوط به HeartMate II یا 3 را نشان می دهد که به عارضه گزارش شده توسط تنظیم کننده ها اشاره می کند. طبق بررسی پایگاه داده سلامت نیوز KFF، اولین چنین گزارشی که نزد FDA ثبت شده است، حداقل به سال 2020 باز می گردد.
هشدار روز دوشنبه دومین فراخوان کلاس 1 دستگاه HeartMate در سال جاری است.
در ژانویه، ابوت یک “اصلاح نامه” فوری به بیمارستان ها در مورد موضوع جداگانه ای صادر کرد که در آن HeartMate 3 به طور ناخواسته به دلیل سیستم ارتباطی پمپ شروع و متوقف می شود، که متخصصان قلب از آن برای ارزیابی وضعیت بیماران استفاده می کنند. FDA در ماه مارس به مردم هشدار داد.
در ماه فوریه، ابوت نامه فوری دیگری در مورد مشکل انسداد به بیمارستان ها صادر کرد و از آنها خواست تا به پزشکان اطلاع دهند، فرم تأییدیه را تکمیل و برگردانند و به آلارم های جریان کم روی مانیتور دستگاه توجه کنند که ممکن است نشان دهنده انسداد باشد. این شرکت در نامه اعلام کرد که در حال کار بر روی یک “راه حل طراحی” برای جلوگیری از انسداد است.
مطالعه ای که در سال 2022 در ژورنال جراحی قفسه سینه و قلب و عروق منتشر شد، انسداد را در حدود 3 درصد موارد گزارش کرد، اگرچه میزان بروز بیشتر بود، هر چه بیمار مدت طولانی تری دستگاه را در اختیار داشت.
تنها فراخوان کلاس 1 دیگری که برای HeartMate 3 صادر شد، در ماه می 2018 بود، زمانی که این شرکت اخطارهای اقدامات اصلاحی را به بیمارستان ها و پزشکان صادر کرد و هشدار داد که خط پیوندی که خون را از پمپ به آئورت می رساند می تواند پیچ خورده و جریان خون را متوقف کند.
اخطار فراخوان FDA که روز دوشنبه صادر شد شامل راهنمایی اضافی برای پزشکان برای تشخیص انسداد با استفاده از الگوریتمی برای تشخیص انسدادها و در صورت نیاز، سی تی آنژیوگرافی برای تأیید علت است.
در حال حاضر، HeartMate 3، که برای اولین بار توسط FDA در سال 2017 تایید شد، تنها گزینه پزشکی برای بسیاری از بیماران مبتلا به نارسایی قلبی در مرحله پایانی است که واجد شرایط پیوند نیستند. HeartMate 3 جایگزین HeartMate II شده است که در سال 2008 تاییدیه FDA را دریافت کرد.
فرانسیس پاگانی، جراح قلب در دانشگاه میشیگان که همچنین بر پایگاه داده اختصاصی ایمپلنتهای HeartMate II و HeartMate 3 نظارت میکند، گفت: اگر فراخوان جدید منجر به حذف دستگاه از بازار شود، بیماران نارسایی قلبی در مرحله نهایی هیچ گزینهای ندارند. .
پاگانی گفت، اگر این اتفاق بیفتد، “ما در مشکل هستیم.” نداشتن این گزینه برای بیماران ویرانگر خواهد بود. این یک گزینه کامل نیست – هیچ پمپی هرگز وجود ندارد – اما این یک گزینه خوب است که همیشه بوده است.
دقیقاً مشخص نیست که چه تعداد از بیماران ایمپلنت HeartMate II یا HeartMate 3 دریافت کرده اند. این اطلاعات اختصاصی است. اعلامیه های فراخوان FDA نشان می دهد که بیش از 22000 دستگاه HeartMate 3 و بیش از 2200 دستگاه HeartMate II در سراسر جهان توزیع شده است.
مادریس کینارد، یکی از مقامات اسبق دستگاه های پزشکی FDA و بنیانگذار Device Events، شرکتی که داده های دستگاه FDA را تولید می کند، گفت: عارضه انسداد ممکن است برای مدت طولانی به مردم گزارش نشده باشد تا حدی به این دلیل که پزشکان ملزم به گزارش عوارض جانبی به تنظیم کننده های فدرال نیستند. کاربرپسندتر برای بیمارستان ها، شرکت های حقوقی و سرمایه گذاران.
فقط سازندگان دستگاه، واردکنندگان دستگاه و بیمارستان ها طبق قانون موظفند جراحات، مرگ و میر و نقص های قابل توجه مربوط به دستگاه را به FDA گزارش دهند.
کینارد گفت: «اگر این چیزی است که پزشکان از آن آگاه بودند، اما موظف به گزارش دادن به FDA نبودند، این ارتباط بین آن دو گروه در چه مقطعی باید انجام شود؟»
Dhruva، متخصص قلب، گفت که او به دنبال شفافیت از Abbott در مورد کاری است که شرکت برای رسیدگی به این مشکل انجام می دهد تا بتواند با بیمارانی که دستگاه HeartMate را در نظر می گیرند، گفتگوهای دقیق تری داشته باشد.
ما انتظار داریم که دادههایی داشته باشیم که میگویند: «هی، ما این اصلاح را ایجاد کردیم، و این اصلاح کار میکند، و مشکل جدیدی ایجاد نمیکند.» این چیزی است که من می خواهم بدانم. صادقانه بگویم، تنها چیزهای دیگری وجود دارد که من در مورد آن احساس تاریکی میکنم، و مطمئن هستم که بیماران و خانوادههایشان نیز همین کار را میکنند.»
[Update: This article was updated at 5:20 p.m. ET on April 16, 2024, with a response from Abbott Laboratories, which it provided after publication.]